Creación de Medicamentos con Inteligencia Artificial
En este tercer post de la serie “Virus, pandemias y modelos computacionales” veremos cómo se puede usar la Inteligencia Artificial, y en particular diferentes arquitecturas del Machine Learning, para crear nuevos medicamentos en mucho menos tiempo y a un costo muchísimo menor que el requerido actualmente por las empresas farmacéuticas.
¡Así que listo, comencemos!
Tabla de contenido
Video
Como siempre, en el canal de YouTube se encuentra el video de este post:
Introducción
Sin duda alguna uno de los grandes retos que enfrentan la Ciencia y la Medicina con la pandemia actual es que hasta el momento no existe un medicamento que permita combatir a este nuevo coronavirus.
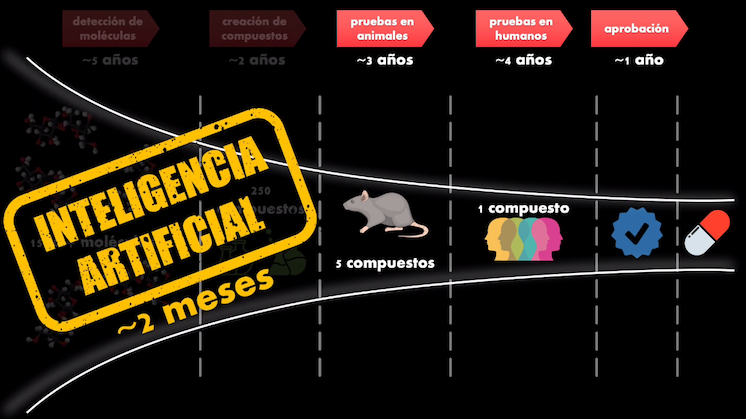
Y es que crear un medicamento no resulta fácil, es un proceso que, con los métodos convencionales, podría tomar entre 10 y 15 años y que tiene un costo que puede llegar a los miles de millones de dólares.
La Inteligencia Artificial, y en particular el Machine Learning, tiene el potencial de reducir parte de este tiempo de desarrollo a un año o incluso menos, y con costos mucho más reducidos. Así que en este post hablaremos cómo la Inteligencia Artificial ha venido acelerando en los últimos años el desarrollo de nuevos medicamentos.
¿Qué es un nuevo medicamento?
El primer paso en la creación de un nuevo medicamento consiste en identificar la sustancia química que causa la enfermedad en el organismo.
Por ejemplo, en el caso del Coronavirus causante de la enfermedad COVID-19 las proteínas espiga que se encuentran en su superficie son las que entran en contacto con las células del cuerpo humano y lo infectan:
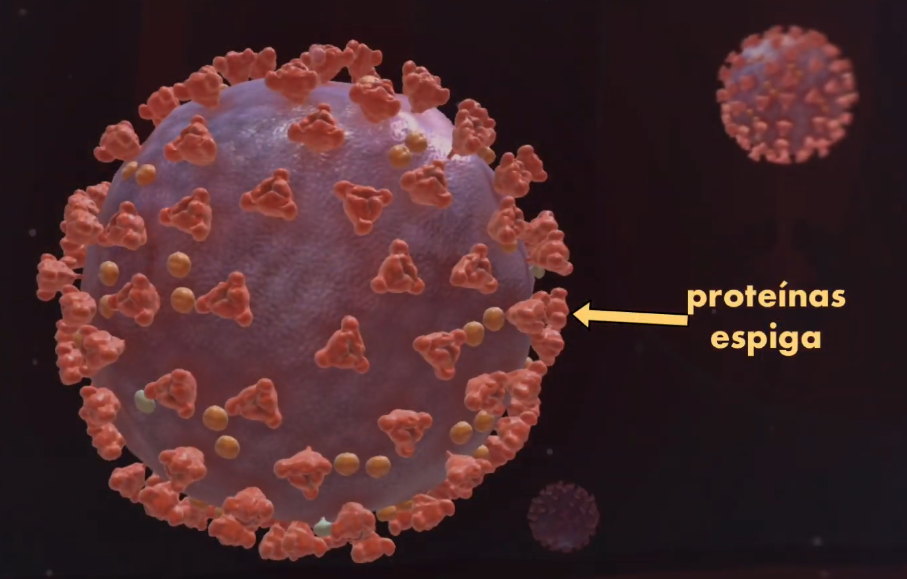
Si miramos en detalle estas proteínas podemos encontrar una molécula, muy pequeña, una pequeñísima parte de la proteína, que es la que permite que el virus infecte el organismo. Vamos a llamar a esta molécula nuestro blanco o target:
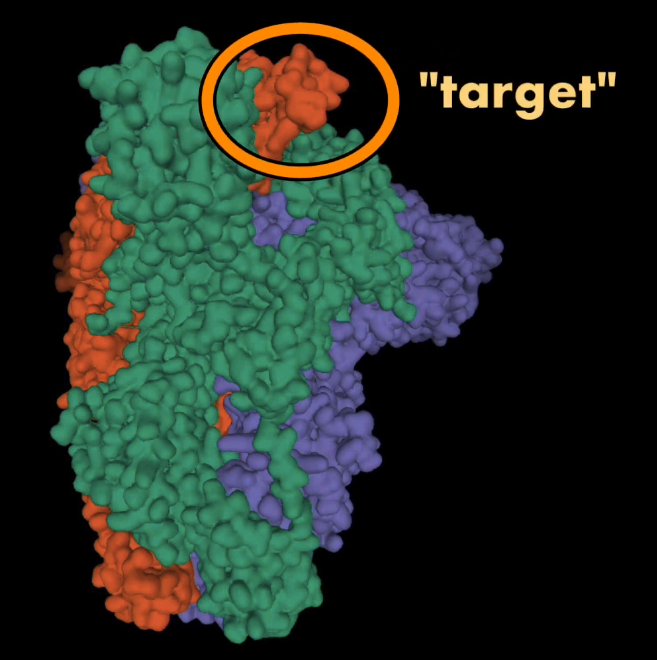
Hasta el momento se sabe que esta pequeña molécula es la que engaña a los receptores ubicados en las células de los pulmones, logrando así que el virus ingrese a la célula y comience a replicarse.
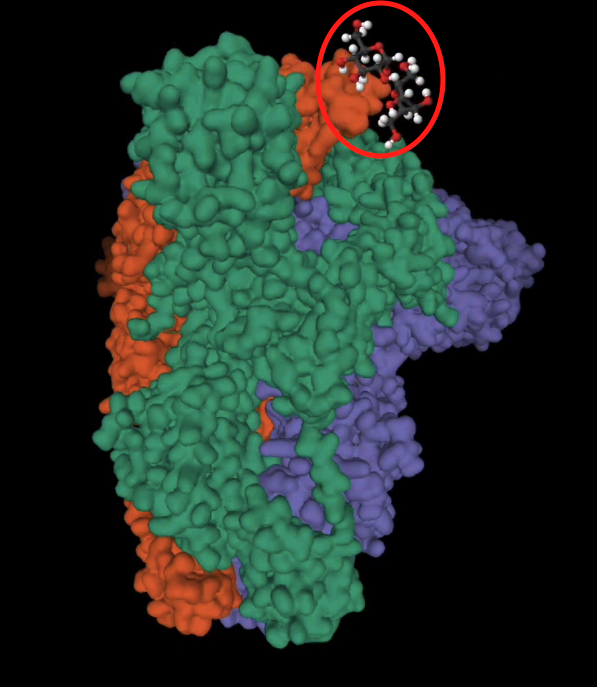
Entonces lo que se busca con un nuevo medicamento es desarrollar una nueva molécula o un compuesto (es decir una combinación de varias moléculas), totalmente sintética, que sea capaz de adherirse al target para neutralizar su efecto, impidiendo que la infección se extienda en el organismo:
Las fases de creación de un nuevo medicamento
Y es acá donde precisamente está una de las fases más complicadas en la creación de un nuevo fármaco.
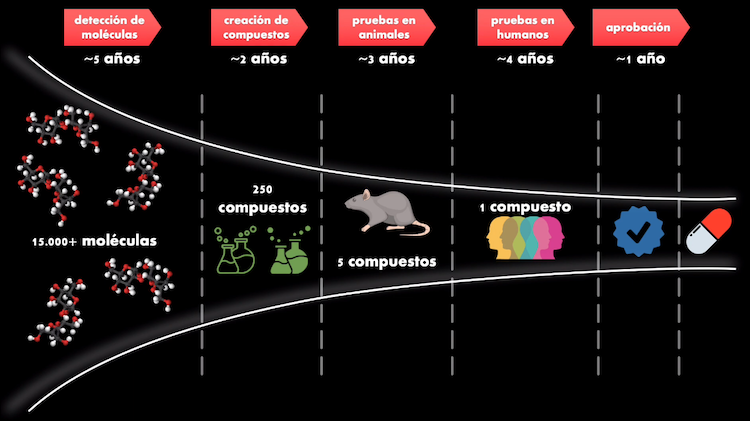
En la actualidad las empresas farmacéuticas han identificado, caracterizado y probado miles, millones de moléculas. Pero encontrar cuál de ellas es capaz de adherirse al target es una tarea extremadamente difícil pues hasta el momento la única forma de hacerlo consiste en sintetizar (¡es decir construir físicamente!) cada una de esas moléculas y, con un proceso de prueba y error, verificar en el laboratorio si esta molécula es capaz de adherirse o no al target.
Esto es como si el target fuese una cerradura y las farmacéuticas fueran un cerrajero. Al crear un nuevo medicamento lo que se busca es encontrar la llave que abra la cerradura, y para ello la empresa farmacéutica debe construir miles de llaves y probarlas una a una hasta que finalmente logre encontrar aquella que encaja perfectamente en la cerradura y logra abrirla. ¡Definitivamente no es la forma más eficiente de hacerlo!
Y este no es el único problema, pues podemos encontrar la llave (o la molécula) que logre hacerlo, que encaje perfectamente en el target, pero es posible que esta molécula genere efectos no deseados en el organismo, o que en el peor de los casos resulte tóxica!!!
Es por esto que la creación de un nuevo medicamento puede tomar en promedio 15 años, desde que se identifican las moléculas que tienen mayor potencial hasta que se prueba el fármaco en humanos y obtiene su aprobación por parte de las entidades regulatorias. Todo este proceso, además del tiempo requerido, puede llegar a costar hasta ¡2.500 millones de dólares!
Y es acá donde entra en juego la Inteligencia Artificial, porque tiene el potencial de CREAR NUEVAS moléculas que son afines al target y que además no resultan nocivas para el organismo. Y para lograr esto no se requiere en principio sintetizar en laboratorio ninguna de estas moléculas, todo ello se puede lograr a través de modelos computacionales de Deep Learning!!!
Los Modelos Generativos para la creación de nuevos medicamentos
Uno de los enfoques más prometedores es el uso de modelos generativos.
Por ejemplo en 2019 la empresa InSilico logró entrenar uno de estos modelos para crear, ¡en tan sólo 21 días!, una nueva molécula para el tratamiento de la fibrosis quística, una enfermedad hereditaria que hace que el cuerpo produzca un líquido anormalmente espeso que se acumula en las vías respiratorias o en el páncreas y que puede potencialmente llegar a ser mortal. Y usando un modelo similar la empresa logro crear, en menos de una semana, nuevas moléculas con el potencial para tratar el COVID-19.
El modelo creado por InSilico es la combinación de dos Redes Neuronales: la primera es capaz de generar nuevas moléculas, mientras que la segunda se encarga de optimizar esa generación, garantizando que las moléculas inhiban las proteínas asociadas a la fibrosis quística:
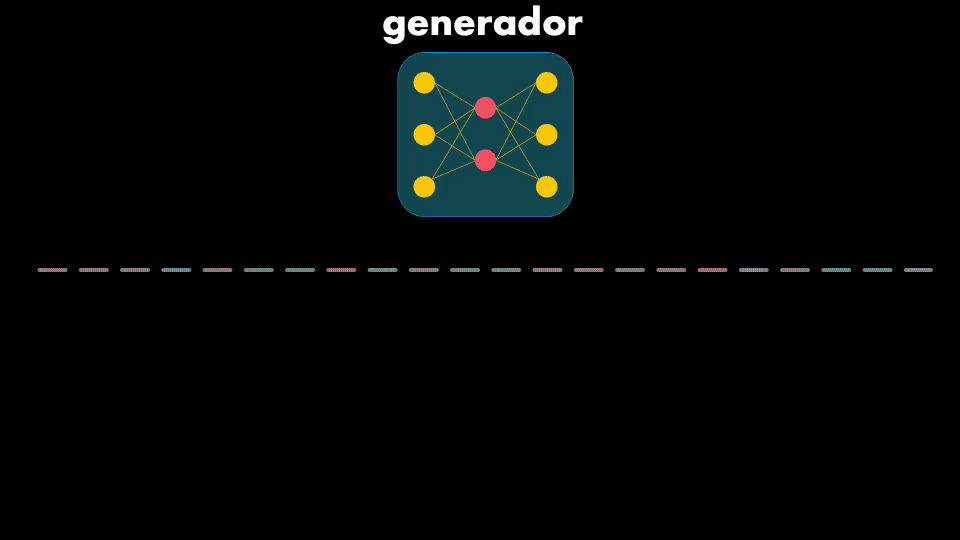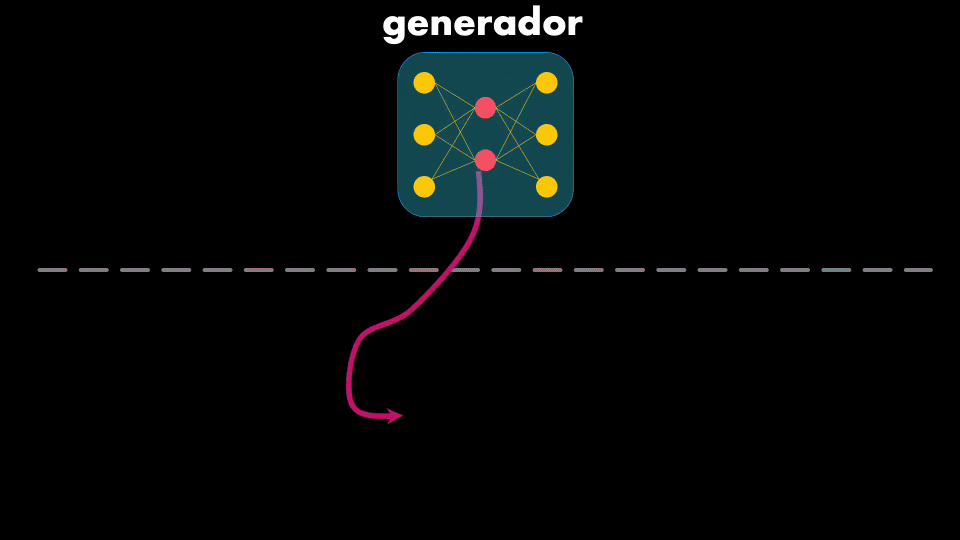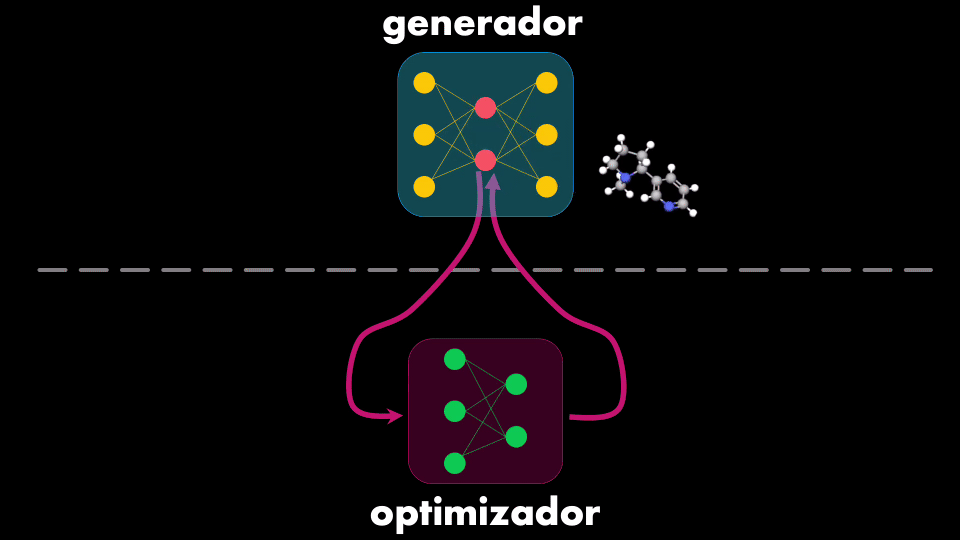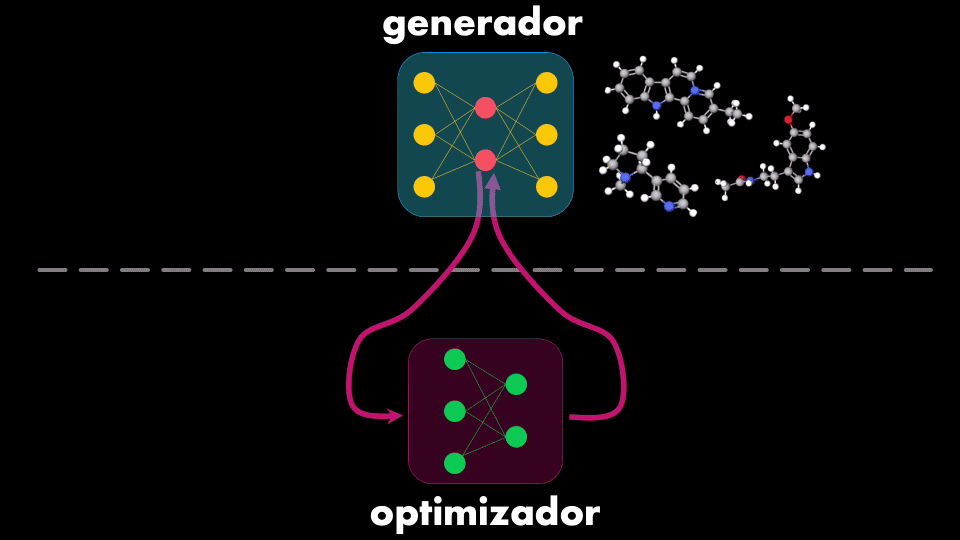
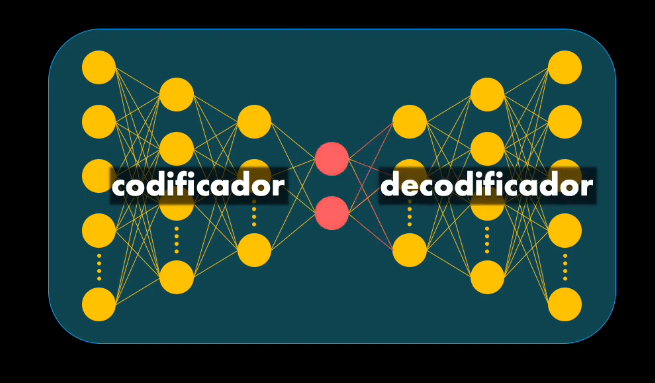
El Generador usa una Red Neuronal que se conoce como Autoencoder, que tiene dos elementos: un codificador y un decodificador. El codificador toma el dato de entrada y aprende a representarlo de manera compacta (es decir con menos información), mientras que el decodificador toma esa versión comprimida y reconstruye el dato original a la salida:
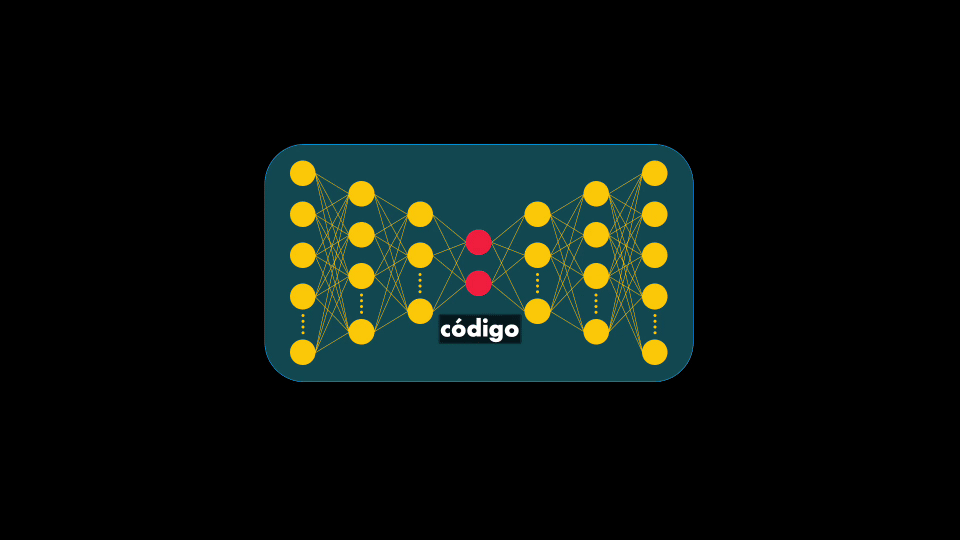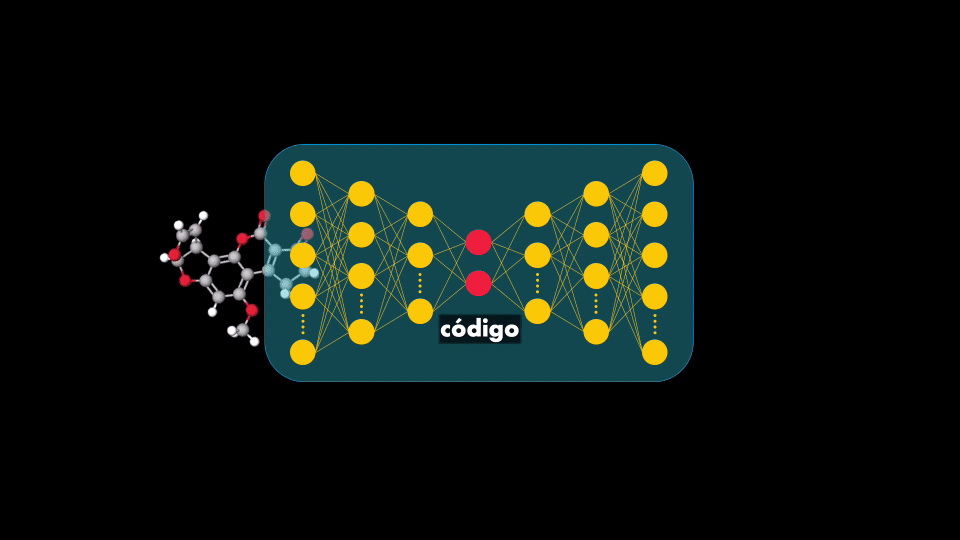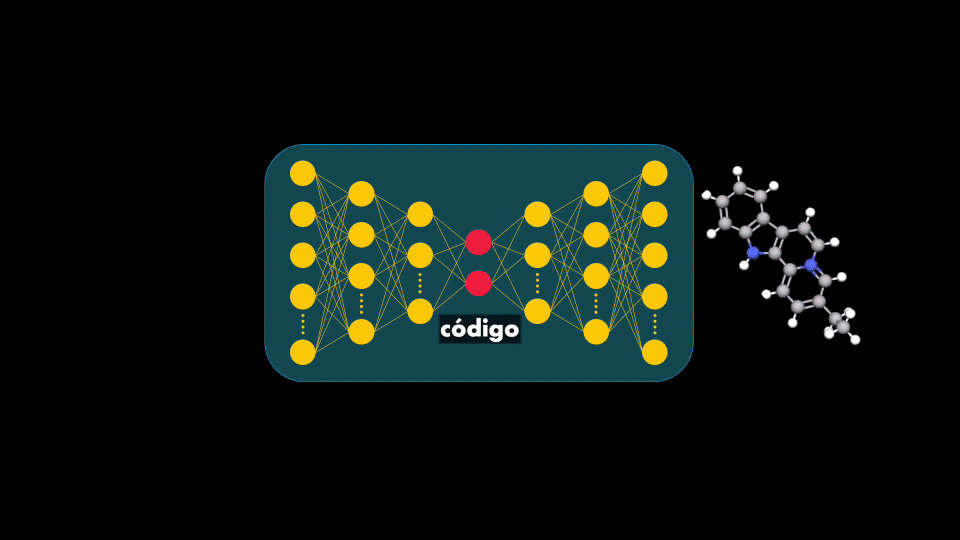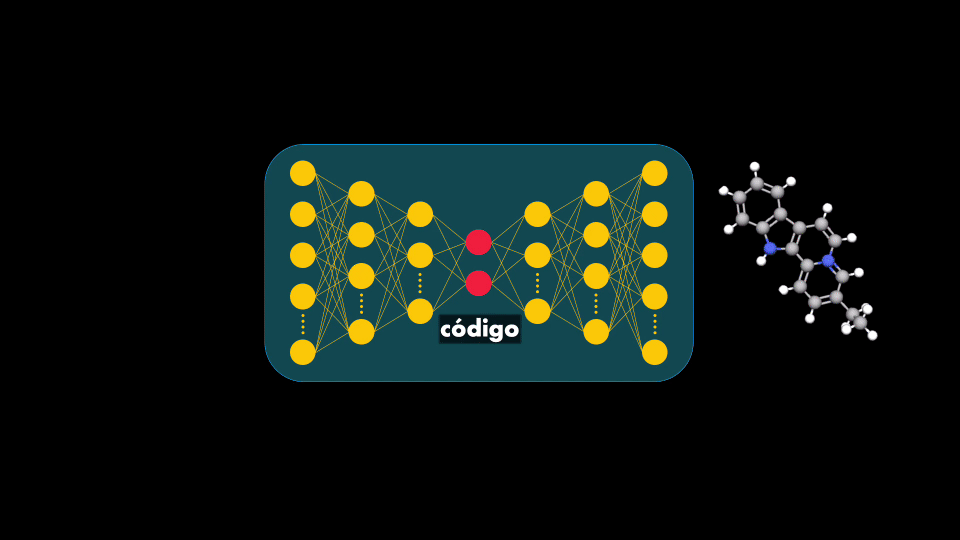
Lo que nos interesa de este Autoencoder es precisamente lo que está en medio: la representación compacta o código. Si se entrena el Autoencoder con secuencias de moléculas usadas en medicamentos entonces el codificador aprenderá a obtener códigos con la información esencial de estas moléculas. Así, al introducir el decodificador se tendrá una Red Neuronal capaz de generar moléculas:
Pero esto no es suficiente, pues la idea no es simplemente generar cualquier molécula: se requiere una red no sólo capaz de generar moléculas: estas moléculas deben ser novedosas (no las mismas usadas en el entrenamiento) y efectivas, y además deben ser moléculas que no resulten tóxicas para el organismo.
Así que al momento de obtener el código se agregan dos elementos: un componente de ruido, lo que permite agregar aleatoriedad al autoencoder y lograr así generar moléculas nuevas, y también reglas para determinar si la molécula generada cumple los criterios para ser un medicamento:
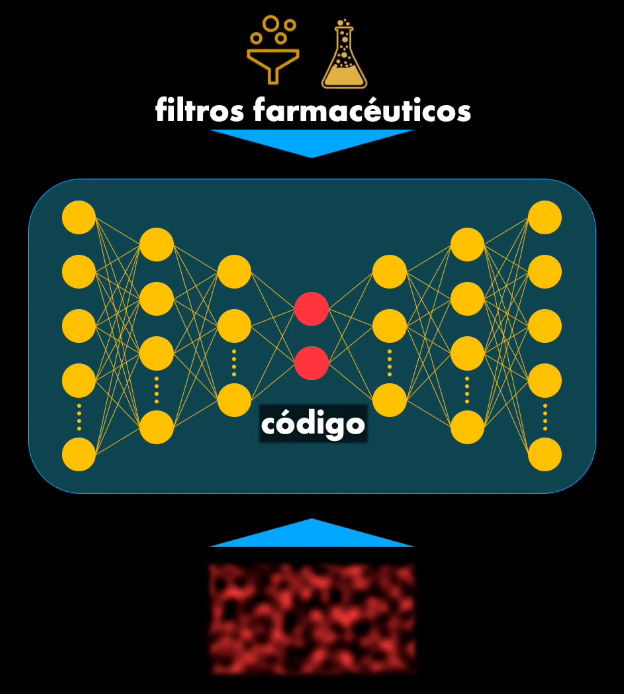
Para entrenar este autoencoder se usan tres sets de datos: MOSES, que contiene casi un millón de moléculas que ya han sido validadas previamente y usadas en medicamentos comerciales y otros dos sets, con más de 25.000 compuestos, que provienen de moléculas experimentales usadas por las compañías farmacéuticas para el tratamiento de la fibrosis quística.
Con esto, el autoencoder será aprenderá a generar nuevas moléculas que con el potencial de ser usadas como medicamentos. Pero esto no es suficiente, pues se busca que esta Inteligencia Artificial sea capaz de generar medicamentos para una enfermedad en particular: la fibrosis quística.
Es aquí donde entra una segunda Red Neuronal, que se encarga de optimizar el proceso garantizando que las moléculas generadas no sólo sean viables como medicamento sino que además tengan el potencial de inhibir las proteínas causantes de la fibrosis quística en el organismo.
En este caso se usa el Aprendizaje Reforzado Profundo, una estrategia de aprendizaje que ha sido muy usada en los últimos años para entrenar inteligencias artificiales capaces de lograr un desempeño superior al del ser humano en los videojuegos, o para enseñar a robots a caminar o a ejecutar acciones similares a las del ser humano, e incluso capaces de superarlo en juegos como Go.
El Aprendizaje Reforzado Profundo (o Deep Reinforcement Learning) se basa en la lógica del castigo y la recompensa: si el código generado por el autoencoder tiene características similares a las de moléculas que ya se usan para el tratamiento de la fibrosis, la Red Neuronal genera una señal de recompensa que indica al autoencoder que el código generado resulta adecuado. De lo contrario genera una señal de castigo que enseña al Autoencoder a no generar este tipo de moléculas:

Para lograr generar estas señales de recompensa o castigo se usó un set con un poco más de 33.000 moléculas ya existentes (desarrolladas por empresas farmacéuticas, y diseñadas específicamente para el tratamiento de la fibrosis.
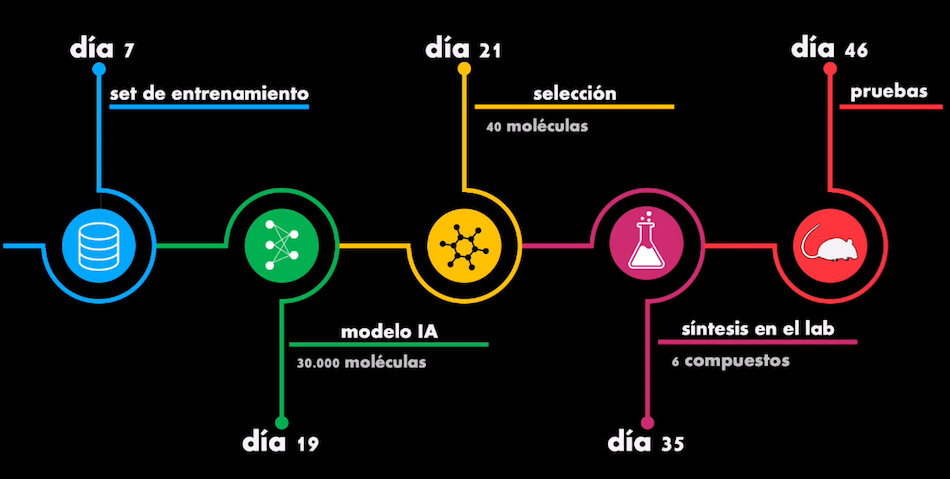
Al combinar el Autoencoder con la estrategia de Aprendizaje Reforzado Profundo, Insilico pudo obtener ¡en tan sólo 19 días! un total de 30.000 nuevas moléculas, de las cuales seleccionaron aleatoriamente 40 y se evaluó su potencial para ser sintetizadas en el laboratorio. Finalmente de estas 40 eligieron 6 moléculas que fueron en últimas sintetizadas y probadas in vitro, y la mejor de estas 6 fue finalmente usada para pruebas en ratones, y se encontró que esta molécula diseñada por la Inteligencia Artificial ¡generaba los efectos esperados para tratar la fibrosis quística!
Al final, menos de 2 meses fueron necesarios para el desarrollo de este nuevo fármaco, lo que resulta impresionante si se compara con el tiempo requerido convencionalmente para el desarrollo de un medicamento, que puede ser de hasta 7 años antes de llegar a hacer pruebas en humanos
¿Y se puede usar esta Inteligencia Artificial para generar medicamentos contra el Coronavirus?
Pero, y ¿todo esto qué tiene que ver con el desarrollo de nuevos medicamentos para tratar el Coronavirus?
¿Recuerdan que al comienzo del post hablamos de la proteína espiga del Coronavirus y de la molécula (o ’target’) que facilita su adherencia a las células del sistema respiratorio?
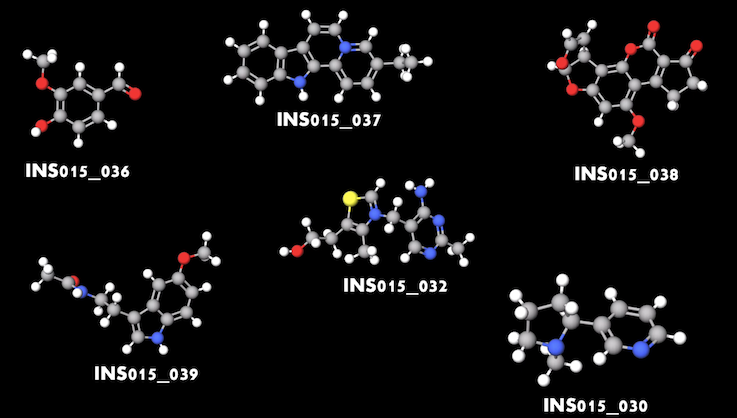
Pues la misma empresa uso recientemente un método muy similar para crear ¡en tan sólo 6 días! 5 nuevos compuestos que tienen el potencial de inhibir este target y que los convierte en candidatos para el desarrollo de nuevos medicamentos para el tratamiento del COVID-19.
Conclusión
Lo que acabamos de ver nos muestra que definitivamente la Inteligencia Artificial tiene un gran potencial el desarrollo de nuevos medicamentos, pues al usar modelos generadores se pueden crear nuevas moléculas en pocas semanas o incluso en unos cuantos días, en comparación con los años que se requieren usando métodos convencionales, y a una fracción del costo que se alcanza actualmente.
Si tienes alguna duda de este artículo o tienes alguna sugerencia no dudes en contactarme diligenciando el siguiente formulario:
Otros artículos de esta serie
- [El modelo SIR: ¿cómo modelar una pandemia?]
- [Modelos Geoespaciales: ¿cómo se propagó el COVID-19 a nivel mundial?]